中学2年理科「水の電気分解」をガッツリ解説していきます。テストにでやすいポイントや、実際の写真を使いながら解説していくので、ぜひ参考にしてみてください!
もくじ
電気分解とは
電気分解とは化学変化の一種です。
化学変化とは、物質が別の物質へと変化することをいいます。
その中でも、1つの物質が2つ以上の物質に分かれるような化学変化のことを分解といいます。
そして、電流を流すことによって物質を分解することを電気分解といいます。

ちなみに、電源装置の-極とつないだ方の電極を陰極、
電源装置の+極とつないだ方の電極を陽極といいます。

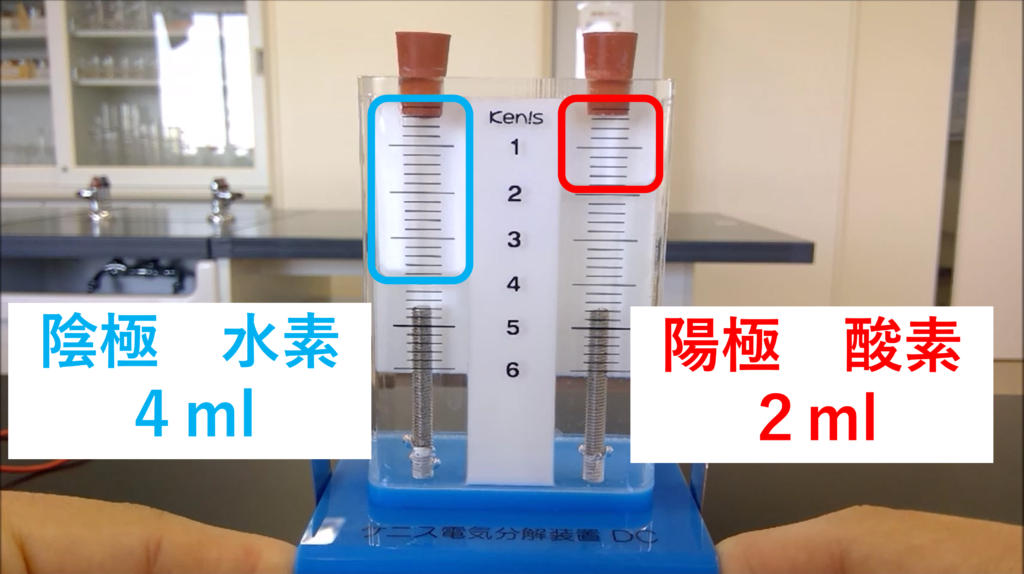
水が分解された結果
水が分解されると、水素と酸素に分かれます。
ポイントは、
・陰極側で水素が発生し、陽極側で酸素が発生すること。
・水素は酸素の2倍の体積が発生すること。
の2点です。テストによく出てくる重要ポイントです!

化学反応式
化学反応式は次のような手順で作ります。
- まずはそれぞれの物質を化学式で表す。
- 次に左辺と右辺それぞれの原子の個数を数える。
- 左右で原子の個数が合うように係数を決める。
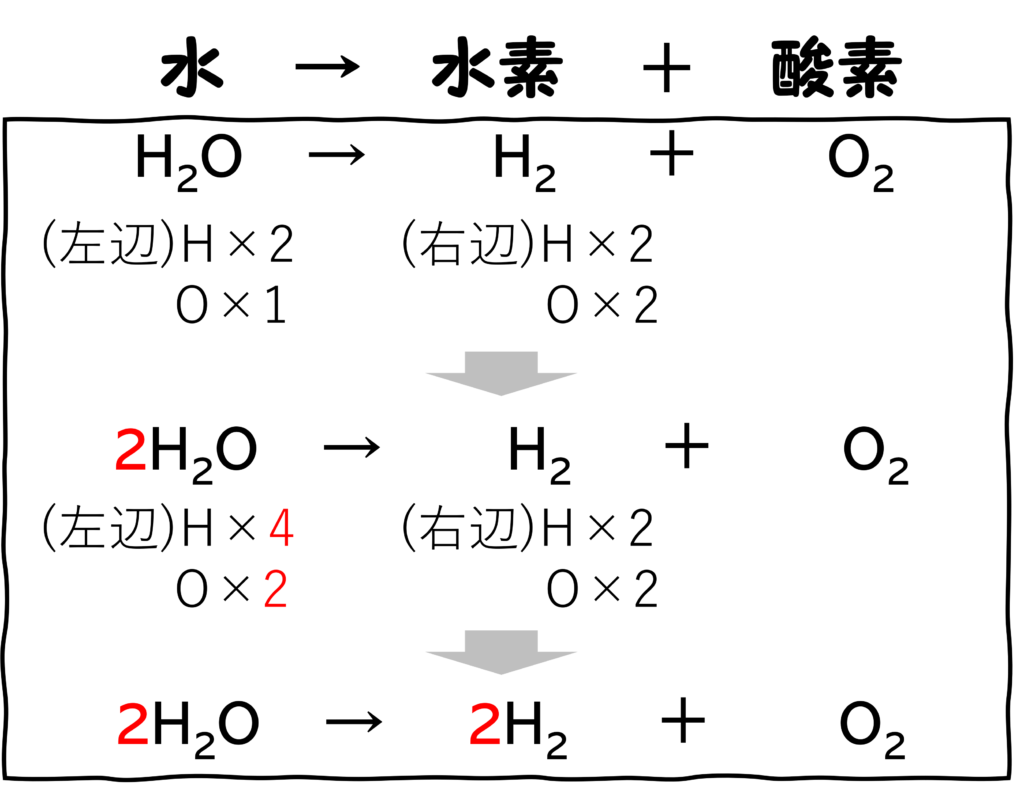
ここで注目してほしいのは、右辺です。
水素の係数は2、酸素の係数は1です。
電気分解で発生したそれぞれの体積が2:1だった理由はこれです!
テストでよく出るポイント
水素を確かめる方法
水素を確かめる方法は、
「マッチの火を近づけるとポンと音を立てて燃える」
です。これはテストにめっちゃ出てきます!他にも水素の性質はテストによく出てくるので、まとめておきます!
・燃える
・最も軽い気体
・無色、無臭の気体
・水に溶けにくい
・鉄や亜鉛などの金属に塩酸を加えると発生する

酸素を確かめる方法
酸素を確かめる方法は、
「線香の火を近づけると激しく燃える」
です。これもめっちゃテストに出てきます!他にも酸素の性質はテストによく出てくるのでまとめておきます!
・ものを燃やすはたらきがある
・無色、無臭の気体
・水に溶けにくい
・空気中の約21%を占める
・二酸化マンガンに過酸化水素水を加えると発生する

水酸化ナトリウム水溶液を用いる理由
実は水の電気分解には、純粋な水ではなく、
「水酸化ナトリウム水溶液」を用いることが多いです。
その理由は純粋な水は電気を通しにくく、電気を通しやすくするためです!
これは水の電気分解では超頻出ポイントなので必ずおさえておきましょう。
最後に
水の電気分解は中2の理科で習いますが、実はその原理を完璧に理解するには中3で習う「イオン」の知識が必須です。
・なぜ陰極で水素、陽極で酸素が発生するのか
・なぜ水が電気を通しにくいのか
・なぜ水酸化ナトリウム水溶液は電気を通しやすいのか
などの疑問は中3ですべて解決されます!
また別の記事で「イオン」についてもガッツリ解説していきますので、そちらもぜひ参考にしてください!